في التفاعل الكيميائي Mg + O2 → MgO ، عدد ذرات كل عنصر على جانبي السهم غير متساوٍ. لذلك ، هذه المعادلة الكيميائية غير متوازنة. إذن ما هي المعادلة المتوازنة؟ دعنا نكتشف أدناه ونتعلم كيفية موازنة معادلة كيميائية.
كيفية وزن المعادلات الكيميائية
كما تعلمت سابقًا ، لا يمكن إنشاء الكتلة أو تدميرها. ينطبق هذا القانون أيضًا على التفاعل الكيميائي. هذا يعني أن الكتلة الإجمالية للعناصر في نواتج تفاعل كيميائي يجب أن تكون مساوية للكتلة الكلية للعناصر في المواد المتفاعلة. يظل عدد ذرات كل عنصر كما هو ، قبل وبعد التفاعل الكيميائي. على سبيل المثال ، دعونا نلقي نظرة على المعادلة الكيميائية التالية :
زنك + حامض الكبريتيك ← كبريتات الزنك + هيدروجين
يتم تبسيط هذا بشكل أكبر
Zn + H2SO4 → ZnSO4 + H2
الآن ، دعونا نلقي نظرة على عدد ذرات كل عنصر على LHS و RHS
- تنبيه RHS تعني الجانب الأيمن من المعادلة
- و LHS تعني الجانب الأيسر من المعادلة
العنصر | عدد الذرات
في المتفاعلات | عدد الذرات
في النواتج |
Zn | 1 | 1 |
H | 2 | 2 |
S | 1 | 3 |
O | 4 | 4 |
كما ترى ، فإن عدد ذرات كل عنصر في الجانب الأيسر LHS والأيمن RHS هو نفسه. لذلك ، هذه المعادلة الكيميائية هي "معادلة متوازنة". الآن ، انظر إلى المعادلة التالية
إذا لاحظت ، فإن عدد ذرات كل عنصر ليس هو نفسه على جانبي السهم. لذلك ، هذه معادلة "غير متوازنة". يمكننا موازنة هذه المعادلة باستخدام الخطوات التالية
الخطوة الأولى
أولاً ، ارسم مربعات حول كل معادلة دون تغيير أي شيء داخل الصناديق.
الخطوة الثانية
اكتب عدد ذرات كل عنصر على جانبي السهم في المعادلة
|
العنصر |
عدد الذرات
في المتفاعلات |
عدد الذرات
في النواتج |
|
Fe |
1 |
3 |
|
H |
2 |
2 |
|
O |
1 |
4 |
الخطوة الثالثة
لموازنة المعادلة أعلاه ، لنبدأ بالمركب مع الحد الأقصى لعدد الذرات ، أي Fe3O4. الآن ، في هذا المركب حدد العنصر الذي يحتوي على أكبر عدد من الذرات ، أي الأكسجين. كما ترون ، هناك 4 ذرات أكسجين على الجانب الأيمن ، بينما توجد ذرة أكسجين واحدة فقط على الجانب الأيسر. دعونا نحاول موازنة ذرات الأكسجين في المعادلة
|
ذرات الأكسجين |
المتفاعلات |
النواتج |
|
الإبتدائية |
1 في H2O |
4 في Fe3O4 |
|
توازن |
1x4 |
4 |
تذكر - لموازنة عدد الذرات في التفاعل ، لا يمكنك تغيير صيغ المركبات أو العناصر في التفاعل. على سبيل المثال ، لموازنة عدد ذرات الأكسجين ، يمكننا إضافة 4 كمعامل للحصول على 4H2O وليس H2O4 أو H2O)4) ، الآن تبدو المعادلة المتوازنة جزئيًا كما يلي
الخطوة الرابعة
الآن ، دعونا نوازن ذرات الهيدروجين في المعادلة
|
ذرات الهيدروجين |
المتفاعلات |
النواتج |
|
الإبتدائية |
8 في |
2 |
|
توازن |
8 |
2x4 |
لذلك ، نضيف 4 كمعامل إلى H2 على الجانب الأيمن. ستكون المعادلة الآن
الخطوة الخامسة
الآن ، ستجد أنه تم ترك عنصر واحد فقط غير متوازن ، أي Fe. دعونا نحاول موازنة ذلك
|
ذرات الحديد |
المتفاعلات |
النواتج |
|
الإبتدائية |
1 في Fe |
3 في Fe3O4 |
|
توازن |
1x3 |
3 |
لذلك ، نضيف 3 كمعامل إلى Fe على الجانب الأيسر LHS
الخطوة السادسة
الآن ، نحسب ذرات كل عنصر على طرفي المعادلة للتحقق من صحة المعادلة
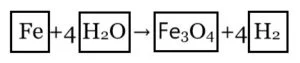
3Fe + 4H2O → Fe3O4 + 4H2
عدد ذرات كل عنصر على كلا الجانبين متساوي الآن ، وبالتالي هذه المعادلة الآن معادلة متوازنة. بينما نجري تجارب لموازنة المعادلة باستخدام أصغر عدد صحيح كمعامِلات ، تُسمى هذه الطريقة "طريقة الضربة والتجربة" لموازنة المعادلات.
الخطوة السابعة
الخطوة الأخيرة هي كتابة الحالات الفيزيائية للمواد المتفاعلة والنواتج. هذا يجعل المعادلة المتوازنة أكثر إفادة. تم ذكر أطوار المواد المتفاعلة والمنتجات باستخدام رموز مثل (g) للغازية ، (l) للسائل ، (s) للصلب و (aq) للمائي. إذا كان المتفاعل أو المنتج موجودًا كمحلول في الماء ، تتم كتابته على أنه مائي (aq).
تصبح المعادلة المتوازنة أعلاه الآن
(3Fe(s) + 4H2O(g) → Fe3O4 (s) + 4H2(g
ملاحظة - بالنسبة إلى H2O ، يتم استخدام الرمز (g) للإشارة إلى استخدام الماء هنا في شكل بخار. عادة لا يتم تحديد الحالات الفيزيائية للمواد المتفاعلة والمنتجات في المعادلة إلا إذا لزم الأمر. في كثير من الأحيان ، يشار إلى ظروف التفاعل مثل درجة الحرارة والضغط والمحفز وما إلى ذلك أعلى و / أو أسفل السهم في المعادلة. فمثلا
أمثلة محلولة لك
السؤال: اكتب المعادلات المتوازنة للتفاعلات الكيميائية التالية
زنك + نترات الفضة ← نترات الزنك + الفضة
هيدروكسيد الكالسيوم + ثاني أكسيد الكربون ← كربونات الكالسيوم + ماء
الجواب: بعد موانة المعادلة نجد: