الهيدروجين عديم اللون والرائحة والمذاق ، وفي الوقت نفسه مادة غازية قابلة للاشتعال وهي واحدة من أبسط العناصر في عائلة العناصر الكيميائية. تحتوي صيغة الهيدروجين على ذرة تحتوي على نواة والتي بدورها تحتوي على بروتون يحمل 1 شحنة كهربائية موجبة ، علاوة على ذلك ، يرتبط الإلكترون الذي يحمل 1 شحنة كهربائية سالبة بهذه النواة أيضًا. ومع ذلك ، في ظل بعض الظروف العادية ، يكون غاز الهيدروجين عبارة عن تجمع سائب لجزيئات الهيدروجين ، كل منها يتكون من زوج من الذرات ، جزيء ثنائي الذرة أي H2.
صيغة وتركيب الهيدروجين
يحتوي الهيدروجين على صيغة كيميائية أي H2. بالإضافة إلى ذلك ، تعتمد كتلته المولية على نظير الهيدروجين الذي ستفكر فيه. الهيدروجين الذي يتكون من نواتين مع بروتون واحد لكل منهما ، له كتلة مولارية 200 جم / مول ، يتكون الديوتيريوم من نواتين مع بروتون واحد ونيوترون واحد لكل منهما ، كتلته 400 جم / مول. والتريتيوم الذي يتشكل من خلال نواتين مع بروتون واحد و 2 نيوترون لكل واحدة ، كتلته 600 جم / مل. علاوة على ذلك ، يتكون هذا الجزيء من ذرتين هيدروجين مرتبطة برابطة أيونية واحدة. يمكننا كتابة تركيبتها الكيميائية كما نوضح أدناه ، في التمثيلات الشائعة المستخدمة للجزيئات العضوية. H-H
الحادثة
الهيدروجين غاز وفير جدًا في الكون كله ، ومع ذلك ، يوجد على كوكب الأرض في آثار الغلاف الجوي وفي بعض الكواكب والنجوم مثل المشتري والشمس ، إلخ. ويمكننا أيضًا إنتاجه بمساعدة البعض الكائنات الدقيقة.
طريقة تحضير الهيدروجين
يمكننا تحضيره بطرق مختلفة مثل:
يمكننا إنتاجه من خلال عملية التحليل الكهربائي للماء التي ينتج عنها الأكسجين الجزيئي والهيدروجين:
2H2O → 2H2 + O2
عندما ننتجها بمساعدة الكائنات الحية الدقيقة ، يتم تصنيع H2 حيويًا بسبب عمل الإنزيمات التي نشير إليها باسم هيدروجينازات.
تصفح المزيد حول التركيب الذري والجزيئي
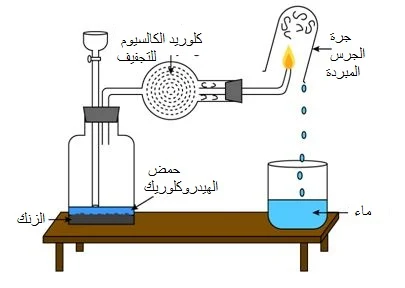
تحضير وتجميع غاز الهيدروجين
نحضر الهيدروجين عن طريق تفاعل الزنك أو المغنيسيوم مع حمض الهيدروكلوريك المخفف:
Zn + 2HCl → ZnCl2 + H2
Mg + 2HCl → MgCl2 + H2
الهيدروجين غير قابل للذوبان في الماء ، لذلك يمكن تجميعه باستخدام جرة غاز في حوض من الماء.
يتفاعل حمض الهيدروكلوريك المخفف بقوة مع المغنيسيوم ويمكن أن يكون خطيرًا.
كيف نكشف عن غاز الهيدروجين
يصدر الهيدروجين بتفاعله مع كمّيّات كبيرة من الأكسجبن عند الاحتراق لهباً لا يرى بالعين المجرّدة، لأنّ له إصدار في منطقة الأشعّة فوق البنفسجيّة، ممّا يتطلّب وجود كواشف خاصّة للهب من أجل الكشف عن الهيدروجين المحترق. في الشروط العادية:
يحترق الهيدروجين مع صوت فرقعة في الأكسجين مع لهب أزرق شاحب مكونًا الماء كبخار ، تظهر هذه العملية في الشكل أدناه.
الخصائص الفيزيائية لغاز الهيدروجين
تبلغ كثافة هذا الغاز 0.089 جم / مل. تبلغ درجة انصهارها حوالي 260 درجة مئوية ، بينما تبلغ درجة غليانها حوالي 252 درجة مئوية.
غاز عديم اللون والرائحة
غير قابل للذوبان في الماء
أقل كثافة من الهواء
الهيدروجين ثنائي الذرة H2
الخواص الكيميائية لغاز الهيدروجين
هذا المركب الكيميائي شديد التفاعل لأن الخلائط مع الهواء يمكن أن تكون متفجرة أيضًا ، ولكن فقط عندما تصل درجة الحرارة إلى 500 درجة مئوية أو أكثر. في درجة حرارة الغرفة العادية ، لم يعد رد الفعل. علاوة على ذلك ، يمكن أن يتفاعل غاز الهيدروجين مع أنواع مختلفة من المركبات الأولية أيضًا ، تمامًا مثل الهالوجينات لتكوين الهيدريدات والأحماض أيضًا:
Cl2 + H2 → 2HCl
S2 + 2H2 → 2H2S
استخدامات غاز الهيدروجين
يعتبر غاز الهيدروجين مفيدًا كمتفاعل في عملية إنتاج الأمونيا وبعض الأحماض مثل HCl و H2S. كما نستخدمه في إنتاج زيت البترول وهو أيضا بديل للوقود الهيدروكربوني
سؤال: يتم تحضير المعدن X بعملية التحليل الكهربائي للكلوريد المنصهر. يتفاعل مع الهيدروجين لصنع مادة صلبة عديمة اللون ينطلق منها الهيدروجين عند معالجته بالماء. هذا المعدن:
(أ). Al.
(ب). Ca.
(ج). Cu.
(د). Zn.
الجواب: (ب). Ca
يتم الحصول على الكالسيوم من خلال عملية التحليل الكهربائي لـ CaCl2. يتفاعل الكالسيوم مع الهيدروجين لإنتاج هيدريد الكالسيوم (CaH2) وهو مادة صلبة ليس لها لون.
يتفاعل هيدريد الكالسيوم مع الماء لإنتاج هيدروكسيد الكالسيوم وغاز الهيدروجين في نفس الوقت:
CaCl2 + H2 + 2 Na → CaH2 + 2 NaCl
لذلك ، فإن الخيار الصحيح هو (B) أي Ca.
أهم المصادر: