تعريف الكهروسالبية
يُعرف ميل الذرة في الجزيء لجذب زوج الإلكترونات المشترك تجاه نفسها باسم السالبية الكهربائية.
إنها خاصية بلا أبعاد لأنها مجرد نزعة. يشير بشكل أساسي إلى النتيجة الصافية لميول الذرات في العناصر المختلفة لجذب أزواج الإلكترون المكونة للرابطة. نقيس السالبية الكهربائية على عدة مقاييس. تم تصميم المقياس الأكثر استخدامًا بواسطة Linus Pauling. وفقًا لهذا المقياس ، يعتبر الفلور هو العنصر الأكثر كهرسلبية بقيمة 4.0 والسيزيوم هو العنصر الأقل كهرسلبية بقيمة 0.7.
إقرأ ايضا : ما هي الكهرباء الساكنة
الاتجاهات الدورية في السالبية الكهربائية
عندما نتحرك عبر فترة من اليسار إلى اليمين ، تزداد الشحنة النووية ويقل الحجم الذري ، وبالتالي تزداد قيمة السالبية الكهربائية عبر فترة في الجدول الدوري الحديث. على سبيل المثال ، تم توضيح اتجاه الكهروسالبية عبر الفترة 3 في الجدول الدوري أدناه.
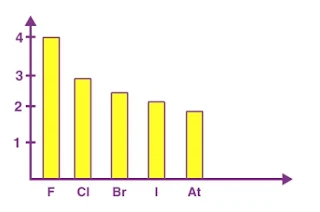
هناك زيادة في العدد الذري عندما ننتقل إلى أسفل المجموعة في الجدول الدوري الحديث. تزداد الشحنة النووية أيضًا ولكن يتم التغلب على تأثير الزيادة في الشحنة النووية بإضافة غلاف واحد. ومن ثم ، تنخفض قيمة الكهروسالبية كلما تحركنا أسفل المجموعة. على سبيل المثال ، في مجموعة الهالوجين أثناء انتقالنا إلى أسفل المجموعة من الفلور إلى الأستاتين ، تنخفض قيمة الكهروسالبية ويظهر في الرسم البياني أدناه.
إنها ملاحظة عامة أن المعادن تظهر قيمة أقل للسالبية الكهربائية مقارنة بالفلزات. لذلك ، فإن المعادن هي كهرو إيجابية واللامعادن بطبيعتها كهروسالبية. تختلف العناصر في الفترة الثانية في الخصائص عن عناصر المجموعة الخاصة بكل منها بسبب الحجم الصغير والقيمة الأعلى للسالبية الكهربائية.
إقرأ ايضا : الخواص الكهربائية للمواد الصلبة
تظهر العناصر في الفترة الثانية تشابهًا مع عناصر المجموعة التالية في الفترة الثالثة. يحدث هذا بسبب اختلاف بسيط في سلبيتها الكهربائية. هذا يؤدي إلى تكوين علاقة قطرية.
معظم العناصر الكهروسالبية والصغرى
الفلور هو العنصر الأكثر كهروسالبية في الجدول الدوري. تبلغ قيمته الكهروسالبية 3.98. السيزيوم هو أقل عنصر كهرسلبي. تبلغ قيمته السالبية الكهربية 0.79. الكهرو ايجابية هي عكس الكهروسالبية ، لذلك يمكننا القول إن السيزيوم هو العنصر الأكثر كهروايجابية.
تلك العناصر التي لا تتطلب سوى عدد قليل من الإلكترونات لإكمال غلاف التكافؤ ، والتي تحتوي على أقل كمية من غلاف الإلكترون الداخلي بين النواة الموجبة و إلكترونات التكافؤ ، هي الأكثر الكهرسلبية. الفلور هو أكثر العناصر الكهروسالبية. كهرسلبيتها 4.0. المعادن لها كهرومغناطيسية أقل من 2.0. أقل العناصر الكهروسالبية هي السيزيوم (Cs) والفرانسيوم (Fr) ، مع قيم كهروسالبية تبلغ 0.7.
لذلك، الفلور هو العنصر الأكثر كهروسالبية والسيزيوم هو العنصر الأقل كهرسلبية.
إقرأ ايضا : الشحنة الكهربائية
تأثير السالبية الكهربائية على الترابط التساهمي
تعتمد قوة الرابطة التساهمية بشكل كبير على السالبية الكهربائية للذرتين المترابطتين (خاصةً الاختلاف في السالب الكهربية للذرات المترابطة). تتميز الجزيئات ثنائية الذرة متجانسة النوى بروابط تساهمية "نقية" نسبيًا نظرًا لأن السالبية الكهربائية للذرات المترابطة هي نفسها (مما يؤدي إلى أن يكون زوج الإلكترونات المترابط على مسافة متساوية تقريبًا من النواتين المترابطتين). يمكن رؤية أمثلة على هذه الروابط التساهمية في جزيئات H2 وجزيئات Cl2 وجزيئات O2.
من ناحية أخرى ، تميل الروابط التساهمية بين نوعين من سلاسل كهروسالبية متفاوتة في الاستقطاب. يحدث هذا لأن الذرة الأكثر الكهروسالبية تسحب زوج الرابطة من الإلكترونات بالقرب من نفسها ، مما يؤدي إلى تطوير شحنة سالبة جزئيًا في العملية (والتي يُشار إليها عادةً بالرمز -𝛿). في الوقت نفسه ، تطور الذرة الأكثر إيجابية للكهرباء شحنة موجبة جزئية (يُشار إليها بالرمز + 𝛿). هذه الشحنات الجزئية مسؤولة عن قطبية الرابطة الكيميائية.
الروابط بين الذرات عالية الكهروسالبية وذرات شديدة الحساسية للكهرباء
في الروابط التساهمية التي تتميز باختلاف كبير في السالبية الكهربائية للذرات المترابطة ، ليس من غير المألوف أن تتحكم الذرة الأكثر كهروسالبية بشكل كامل في زوج الرابطة من الإلكترونات ، مما يؤدي إلى تكوين اثنين من الأيونات. هنا ، تشكل الذرة الأكثر كهرو سالبية أنيونًا وتصبح الذرة أكثر كهرو إيجابية كاتيونًا.
من المهم أن نفهم أن جميع الروابط التساهمية بين الأنواع غير المتشابهة لها بعض الخصائص الأيونية. وبالمثل ، فإن جميع الروابط الأيونية لها بعض الطابع التساهمي أيضًا. يتم تحديد الطابع الأيوني للرابطة التساهمية من خلال الاختلاف في الكهروسالبية. عندما لا تكون الكهروسالبية للأنواع المرتبطة مختلفة تمامًا ، ستكون الرابطة تساهمية أكثر من الأيونية. ومع ذلك ، عندما يكون هناك اختلاف كبير بما فيه الكفاية في الكهروسالبية للذرات المترابطة ، تصبح الرابطة قطبية بما يكفي لاعتبارها أيونية أكثر من التساهمية.
إقرأ ايضا : المعادن المغناطيسية والغير المغناطيسية
جدول الكهروسالبية
الكهروسالبية هي خاصية كيميائية تصف قدرة الذرة في الجزيء على جذب الإلكترونات لنفسها. هناك فرق كبير في الكهروسالبية للذرات من الجانبين الأيسر والأيمن من الجدول الدوري. الكهروسالبية هي كمية مهمة في تحديد طبيعة الروابط بين العناصر و تعتبر العامل الرئيسي في الترابط الكيميائي.
الجدول الدوري للعناصر مع جدول الكهروسالبية موضح أدناه
العوامل المؤثرة في الكهروسالبية
1. حجم الذرة:
سيؤدي الحجم الذري الأكبر إلى قيمة أقل للسلبية الكهربية ، وهذا يحدث لأن الإلكترونات البعيدة عن النواة ستختبر قوة جذب أقل.
2. الشحنة النووية:
ستؤدي زيادة قيمة الشحنة النووية إلى قيمة أكبر للسلبية الكهربائية. يحدث هذا لأن الزيادة في الشحنة النووية تؤدي إلى جذب الإلكترون بقوة أكبر.
3. تأثير البديل:
تعتمد القدرة الكهروسالبية للذرة على طبيعة البديل المرتبط بتلك الذرة. على سبيل المثال ، تكتسب ذرة الكربون في CF3I شحنة موجبة أكبر من CH3I. لذلك ، فإن C-atom في CF3I هي أكثر كهروسالبية مما كانت عليه في CH3I. ينتج عن الاختلاف في كهروسالبية الذرة الناتجة عن البدائل سلوك كيميائي مختلف لتلك الذرة.
الأسئلة المتداولة حول الكهروسالبية
ما هو أفضل تعريف للسالبية الكهربائية؟
الكهروسالبية هي دالة لقدرة الذرة على جذب زوج ربط الإلكترونات. الأكثر استخدامًا هو مقياس بولينج. تم تعيين الفلور بقيمة 4.0 ، والقيم الأقل كهروسالبية عند 0.7 تتراوح من السيزيوم والفرنسيوم.
ما هي الطاقة الكهروسالبية العالية؟
تتناقص السالبية الكهربائية في الفئات من الأسفل إلى الأعلى وتزداد بمرور الوقت من اليسار إلى اليمين. وبالتالي ، فإن العنصر الأكثر كهروسالبية هو الفلور ، بينما الفرانسيوم هو أحد العناصر الأقل كهروسالبية.
ما هو فرق السالبية الكهربائية؟
يتم وصف الدرجة التي تجذب بها الذرة الإلكترونات في رابطة كيميائية بواسطة الكهروسالبية. إذا كان الفرق في الكهروسالبية أكبر من 1.7 ، فإن طبيعة الرابطة ستكون أيونية. إذا كان الفرق في الكهروسالبية بين 0.4 و 1.7 ، فإن صفة الرابطة تساهمية قطبية.
ما هو الفرق بين تقارب الإلكترون و السالبية الكهربائية؟
الفرق بين الاثنين هو أن الكهروسالبية هي خاصية كيميائية توضح كيف يمكن للذرة أن تجذب الإلكترونات إلى نفسها كمقدار من الطاقة المنبعثة عند إضافة إلكترون إلى ذرة محايدة.
هل السالبية الكهربائية كمية نسبية؟
الكهروسالبية مثال على قدرة الذرة على جذب الإلكترونات. إنه يتناسب مع الفرق بين احتمال تأين الذرة وجاذبيتها للإلكترون.